Archive: 2020
判断eTMF是否优质?先看看这7个要素!
Reading Time: < 1 minute本文作者:Medidata中国区高级解决方案顾问黄天娇 试验主文档(Trial master files, TMF)可以包含100,000个以上的文档,约35%的临床试验检查会因为TMF不完整或不易获得而延迟。 如何简化试验内容的监查是eTMF管理的初衷。10多年前,生命科学行业配置的文档管理系统,从基于纸张的文件转移到受监管的环境中。这些被动的系统设计目的通常是存档,没有提供自动化的工作流或度量,不是管理。在过去的这个5—10年间,eTMF系统层出不穷,并且经常作为整体技术层面上的信息管理战略存在。如今,先进的eTMF系统有了更多附加的功能,比如支持内容管理的前瞻性方法和工作流、临床试验质量度量、警报、通知等关键功能,以及与CTMS、EDC的集成等。 总之,一个优质的… Read More

快速变化的全球临研环境中,有效管理试验的四种方法
Reading Time: < 1 minute在过去的半个世纪里,临床试验变得越来越复杂。新来源的数据呈井喷之势,加上更精细的研究设计和更严格的监管标准,临床试验的周期延长,成本上升,导致效率的逐步下降。所有这些加在一起:近半新药上市收益低于预期。如果这还不够,COVID-19在全球范围内的爆发正在对生命科学公司的运营方式产生影响,包括临床试验的开展方式。 大多数临床试验研究机构都试图通过这里调整一个平台,那里添加一个新的应用程序,来作出改善。但这只是产生了网站、电子表格和仪表板的拼凑系统,进一步加重了研发过程中的负担。据统计,在当今的临床试验工作流程中平均使用了超过25种不同的解决方案,这使得数据可追溯性、人类受试者监督和及时付款成为一项艰巨的任务。其中的风险是巨大的:向监管机构报告严重不良事件时出现错误,支付错误以及数据安全漏洞。 临床试验运营人员面临着前所未有的压力。尤其是此次新冠肺炎大流行给传统的临床试验方式带来了考验,在疫情后时代也对制药公司、CRO等产生了深远的影响。疫情卷土重来的潜在风险,远程收集患者数据、试验药物直接寄送以及通过集中平台管理系统的技术,将有助于企业更有效地管理试验。 Medidata 为您带来的解决方案以及功能,作为Medidata Rave临床云的一部分,协同合作将将极大地简化试验管理。 中心化数据分析 机器学习是统计分析和升级异常检测的有力工具。Medidata Detect等产品可以在不到一小时的时间内处理100多万个数据点和4000个数据模式。六分之一的新药申请在第一轮审批中失败,增强的分析能力对于持续监测的价值可见一斑。机器学习在应对以下几个方面的问题时表现出色:… Read More

当前全球临床试验监管机构关于eTMF的法规现状
Reading Time: < 1 minute本文作者:Medidata中国区高级解决方案顾问黄天娇 eTMF对于试验文档的管理应该是一个动态的过程,便于真实、完整地重现临床试验中采取的所有行动,所以应该从更高的级别去确保合规的要求,从而降低申办方、CRO以及研究中心的业务风险,从容应对相关监管机构的审查。 如何避免审查中出现问题,我们首先为您梳理全球相关法规的现状及要求。 美国FDA 美国FDA 的ICH GCP E6 R2中提出了TMF必要文件的概念。文件是单独存在还是联合出现?如何评价临床试验的实施以及所产生的数据质量?这便是其中必要文件的目的,即支持申办方的独立稽查和监管机构的检查。同时,必要文件还需要按照不同的阶段进行分组,试验前、试验中、试验后三个不同的阶段。在试验开始阶段,要求建立TMF,文档被妥善存储并且具备可识别性。可识别性包括能够查看历史文档的版本,能够进行文档的搜索和检索等。而对于必要文档的范围,法规中也做出了灵活的规定,依据项目的实际情况调整。但是,FDA并没有明确定义eTMF的概念。对于在本土开展的临床试验中eTMF的管理,美国联邦法规CFR,也并没有正式的法规出台,目前仍旧按照ICH GCP的规定执行。 欧盟EMA 相比美国FDA,欧盟EMA对于… Read More

BYOD?eCOA的未来?
Reading Time: < 1 minute电子临床结果评估(eCOA)已问世多年。从功能上讲, eCOA需要配备硬件,无论是平板电脑还是手持设备,以方便中心和受试者提供和录入数据。在过去的几十年中,技术的便利性呈指数级增长,行业对于使用技术的优势——受试者利用自带的智能手机等设备访问并完成研究问卷——的兴趣也日渐增长。 BYOD应用的积极信号 Medidata以坚实的技术为重心,开发了基于灵活性和可伸缩性的eCOA解决方案的应用程序(“app”),根据给定试验要求,配置最佳解决方案,支持传统的预配置、纯粹的“自带设备”(Bring Your Own Device, BYOD),或者自由组合。 目前,使用BYOD采集的数据支持试验关键终点,还缺乏明确的法规指南。全球监 管机构如FDA已经发出积极信号,对电子数据采集方式朝着BYOD模式发展表示认可,但同时担忧也同样存在。首先,受试者不应该仅因为不能负担昂贵的硬件设备而被排除在临床试验之外。事实上,在可预见的将来,使用eCOA的试验在一定程度上向受试者提供设备将成为现实,这样既可以支持没有合适设备的受试者,也可以支持不愿意使用自有设备的受试者。 其次,FDA提示在一项试验中使用许多不同类型的设备,有可能为受试者报告的数据引入更多可变性。临床试验一直在与不受控制的变异性作斗争,但在过去几十年里,人们针对不同的模式和设备类型所获得的数据的可比性进行的大量研究,结果表明,受试者对不同的用药模式的回答是一致的。 关于数据可比性问题,在监管机构作出明确声明之前,建议在为特定试验制定COA战略时,与监管机构讨论BYOD方法的适当性和任何额外试验的潜在需要。这样的做法特别适用于III期试验,尤其是数据需要支持关键终点时。对于II期试验或者探索性终点,可能会有更多的灵活性。实际上,对于BOYD设备来说,这些应用场景有助于其证明在未来更大的关键试验中的适用性。… Read More

Medidata洞见 | 精准医疗赋力罕见病研究
Reading Time: < 1 minute还记得2014年,在全球社交媒体掀起热潮的“冰桶挑战”吗?从那时起,罕见病“渐冻人症”即肌萎缩侧索硬化症开始为大众所熟知。 最近,Medidata携手非盈利组织Project ALS,计划利用精准医疗解决方案Rave Omics,拯救这些渐冻人被“囚禁”的灵魂。[1] 近几年,风口浪尖上的精准医疗如何在药物研发中成功破局? 精准医疗三大看点 看点一、精准医疗 大势所趋 精准医疗也被称为个性化医疗。精准医疗正伴随着中、美各国的精准医疗计划,招徕各路资本竞逐。这种基于一个人的基因、生活方式和环境所单独制定医疗方案的技术,将“病”的深度特征和“药”的高度精准性进行匹配,无疑是一场新的技术革命。 自国家发改委2016年公布“十三五”规划纲要,“基因组学”已经被正式列入国家战略部署,… Read More

后疫情时代,临床试验如何赢在起跑线
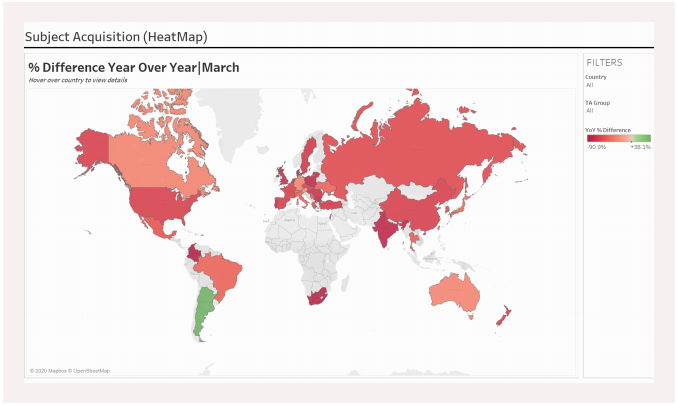
Reading Time: < 1 minute4月8日,中国迎来武汉的全面解封。而在全球,COVID-19依旧肆虐。Medidata密切追踪疫情对临床试验造成的影响,把握全世界监管机构的动向。《Medidata独家视角:疫情影响下的全球临床试验》2.0版来了,4月更新一并奉上。 据Medidata数据显示, 全球大部地区患者招募受到严重影响,3月,全球临床试验入组数相较2019年,同比下滑65.1% 截至4月6日,欧洲药品管理局(EMA)、美国食品药物监督管理局(FDA)、英国药品和保健品管理局(MHRA)、英国国家卫生服务系统(NHS)及英国卫生和社会护理部(DHSC)、日本药品和医疗器械管理局(PMDA)、加拿大卫生部、新加坡卫生科学局(HSA)、美国临床研究组织协会(ACRO)和多个伦理审查委员会已发布了针对新冠大流行期间临床试验措施的更新版应急指导。 在中国,3月参与临床试验的新入组患者较去年同期减少了68%,但可喜的是,3月新增数量较2月增长240%,这是中国临床试验正逐步回暖的积极信号。 按照疾病治疗领域划分,新入组患者下降数量也各有不同表现。(点击链接获取详情) 疫情终会退潮,行业数字化大势始终如一,在后疫情时代风头更劲。中国的临床研究如何拨云见雾,Medidata解决方案可以助您一臂之力。 你有一份试验指南待查收 指南一:七十二变全掌握 Acorn AI… Read More
深究疫情困境,Virtual Trials如何助力临床试验变革?
Reading Time: < 1 minute在COVID-19疫情中,国内临床试验面临前所未有的考验。如何应对此种突发情况,在抗“疫”攻坚的数月中,数字化转型是其中最常提及的关键词,成为疫情中和疫情后整个行业都在考虑的问题。 同时,随着疫情的全球扩散,3月19日,美国FDA在其网站发布了针对制药行业、研究人员和机构审查委员会/伦理委员会的行业指南《FDA关于在COVID-19大流行期间进行医疗产品临床试验的指南》。当中指出由于受试者可能无法前往研究地点进行方案规定的随访,因此申办方应评估是否可以进行安全性评估的替代方法,例如电话联系,远程随访等。这也为虚拟试验的进一步发展释放出积极信号。 疫情中凸显出数据收集困难、数据质量问题以及患者依从性等问题,疫情之后,临床试验未来之路究竟如何走?来听听大咖怎么说! 数据收集和患者依从性的问题并非疫情期间的个案。据统计,完成I期临床试验的新药平均只有10%可以成功上市。其中部分原因是到了III期,患者参与率会下降30%以上。 在试验计划之初利用新技术从源头上解决此类问题,只有以患者为中心的试验设计才能真正提高患者参与度和依从性,进而保障数据收集的数量及质量。正是基于此理念,虚拟试验 (Virtual Trials)在面对新冠肺炎疫情类似的突发事件时可以将负面影响降低到最小。 说起… Read More

特快专递|Medidata独家视角:疫情影响下的全球临床试验
Reading Time: < 1 minute新冠疫情蔓延至全球,从各国不一的隔离政策,到重压下的医疗资源以及捉襟见肘的防护物资,熟悉的场景一再重现,也让我们看到了全球抗疫形势的严峻以及疫情对于临床试验的深远影响。 3月24日,Medidata Solutions 全球总裁和联合创始人 Glen de Vries发表推文,作为全球领先的生命科学临床研究领域云解决方案供应商,Medidata将以我们在生命科学以及临床试验领域的深刻洞见为客户、终端用户带来更专业的服务。针对疫情下的临床试验困境,Medidata 将推出系列专题见解:COVID-19疫情下的全球临床试验,请点击详情查看。 在全球范围内,无论是在地区层面,还是在研究中心层面,都对我们的行业产生了深远的影响。从当地实际情况出发,确定疫情当下的应对方案乃至疫情后未来的临床试验运营优化至关重要。今后我们将陆续发布关于疫情期间及未来整个行业趋势的最新分析报告。… Read More

共克时艰|疫情下的临床试验“大考”,Medidata为您带来“破题”神器
Reading Time: < 1 minute新冠疫情爆发影响着诸多行业2020年的发展,对于临床试验领域来说尤其如此。医务人员抽调湖北,普通病人入院受限,试验开展面临搁浅,临床试验的这场“大考”难题不断,Medidata为您带来“破题”神器。 数据采集的困境 考题1: 此次新冠肺炎疫情给临床试验带来的挑战中,首当其冲的就是受试者无法及时来研究中心进行随访,相关数据也无法及时收集。这也给我们带来了一个思考:是否可以在试验计划之初就可以利用新技术将受试者往来医院的频次降低从而减少受试者与研究中心的负担? “考试”神器: 虚拟试验 (Virtual Trials)在面对新冠类似的突发事件时可以将负面影响降低到最小,并且有助于加快试验进程: 可直接采集受试者的穿戴设备、手机、电子记事本等多平台信息,从而消除对多个供应商、复杂设置、多次登录或昂贵、易出错的手动数据整合的需求; 自动化患者知情同意和入组流程,改善整体的知情同意书管理,减少错误,从而减轻研究中心和研究团队的管理负担; 更高质量的数据和病患的依从性:研究显示,相较传统的纸质病患日记11%的合规率,电子日记的实际合规率高达94%,… Read More

临床试验吐槽大会,不吐不快
Reading Time: < 1 minute转眼间2019飘然而去,在临床试验领域的各位医疗界同仁一年的辛勤劳作,来听听临床试验19吐槽大会中的这些不吐不快吧。 CRA:数据核对真是耗时耗力,临床数据哪里都是 – 手写的、电脑上的,一堆Excel,存储在各种平台上,都要我们一一核对,还得强行记住不同系统平台的登录密码。同事那边要是改了纸质文件,还要我在电脑上再改一遍。工作量已经大到令人自闭!更不要说还得花大量时间跟医生或CRC沟通。看看我这日渐上移的发际线…..哎,我太难了! 医生:看诊、写论文忙得我脚不离地,孩子家长会我就没露脸过。还有临床试验这块要忙,要不是记录有CRC做,我就算是三头六臂、吸风饮露也忙不过来啊? 患者:我家离研究中心一个半小时的车程,往返3小时,还每周都要去。上有老、下有小,得个病已经搞得家里鸡飞狗跳了,真的需要流程可以更简单些! 另一患者:可不是嘛!并且说真的,当时咱们签的知情同意上好像也不记得有说要这么复杂的操作。说到底,从一开始入组我们就是不清不楚的! 监管部门:我们也不轻松,好吗?我们希望申办方提交的数据、报告、各项指标清晰明了,一目了然。可是,有些研究机构内部质量控制环节就很薄弱,对所发现的问题记录不全、描述不清,还有试验药物管理不规范的,管理制度、SOP更新和实践脱节的。这样不规范的试验中研究出的药物要是流向市场,那我们良心何安啊! 成年人的世界里… Read More

