Medidata Blog
포스트 코로나 시대의 새로운 대안, 성공적인 원격 모니터링을 위한 메디데이터의 제언

by 김희영 Sr. Solution consultant, Medidata
지난해 말부터 전세계를 휩쓴 코로나19는 임상시험 과정에 중요한 변화들을 가져오고 있습니다. 특히 팬데믹으로 인해 임상시험 모니터요원(CRA)의 현장(on-site) 방문이 극히 제한되며 임상시험의 원활한 진행을 위해서는 “컴플라이언스를 준수하며 데이터의 품질을 유지할 수 있는” 대안이 요구되는 가운데, 글로벌 규제기관과 스폰서들은 임상시험의 원활한 진행을 지원하는 원격 모니터링(remote monitoring) 기술을 주목하고 있습니다.
현장 모니터링의 보완책으로 부상하는 원격 모니터링
원칙적으로 CRA의 현장 방문이 필요한 주요 이유 중 하나는 임상시험의 진행단계별 주요 정보와 환자에 대한 민감한 정보가 담긴 자료에 대한 검토와 확인(SDR/SDV)이 필요하기 때문입니다. 하지만 코로나19등 외부적인 요인으로 시험기관에 대한 접근이 어려워지며, 원격 모니터링으로 근거문서의 사본을 통해 데이터를 점검하고 임상시험관리기준과의 적합성 여부를 평가하는 과정이 제한적인 상황을 극복하는 훌륭한 보완책 또는 대안이 될 수 있습니다.
이미 미국 식품의약국(FDA), 영국 의약품건강관리제품규제청(MHRA) 등 북미, 유럽, 그리고 아시아·태평양 지역의 국제 규제기관들은 가이드라인을 빠르게 개정하고 원격 모니터링 기술의 도입을 권고하고 있습니다.
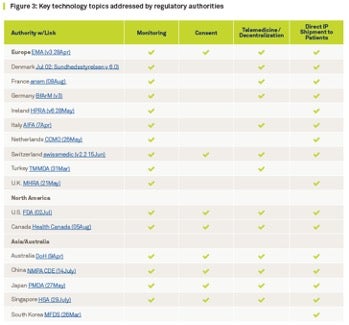
[전세계 규제기관에서 논의되고 있는 임상시험 관련 기술의 주요 주제들]
한편 모니터링을 도입하고자 하는 업계의 움직임 역시 활발해지고 있습니다. 국제학술지 네이처(Nature)가 진행한 연구 조사 결과에 따르면, 항암 임상시험을 진행하고 있는 기관 중 73%가 현장 방문을 줄이고 원격으로 전자의무기록(EMR)를 검토하는 것을 계획 중이거나 이미 진행 중이라고 응답하였습니다. 메디데이터 역시 해외 6개국에서 진행되는 7개의 연구와 국내 1곳에서 진행 중인 시험의 원격 모니터링을 지원하고 있으며, 전세계 10위권 제약사를 포함한 고객사를 비롯한 파트너들과 관련 논의를 활발하게 진행하고 있습니다.
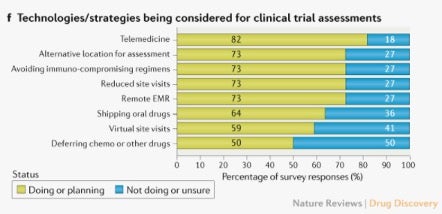
[임상시험의 진행을 위해 고려되고 있는 기술 및 전략에 대한 Nature지의 연구 조사 결과]
원격 모니터링의 효과적인 수행을 위한 고려사항
주목할 점은 상당수의 규제기관들이 원격 모니터링을 진행 시 위해성 기반 모니터링(Risk-Based Monitoring)을 기반으로 한 접근을 권고하고 있다는 점입니다. 위해성 기반 모니터링(RBM)은 임상시험의 운영 과정에서 발생할 수 있는 위험을 사전에 정의하여 파악 후 위해 요소의 정도에 따라 임상시험의 품질을 관리하는 방법으로, 데이터 품질에 대한 전반적인 감독이 가능하고 시시각각 변화하는 상황 속에서도 임상 시험을 일관적으로 진행하여 규제기관의 요구사항에 부합하여 임상시험을 진행할 수 있습니다. 다시 말해 시험 기관에 대한 접근이 엄격하게 제한된 상황 속에서는 RACT(Risk Assessment Categorization Tool)을 통해 리스크를 정의한 뒤, 통계적 기법을 활용한 Central monitoring(Medidata Detect)을 통해 분석되어 찾아진 문제를 빠르게 포착하고 원격 모니터링을 통해 문제가 발생한 소스 데이터에 접근하는 방식이 필요합니다.
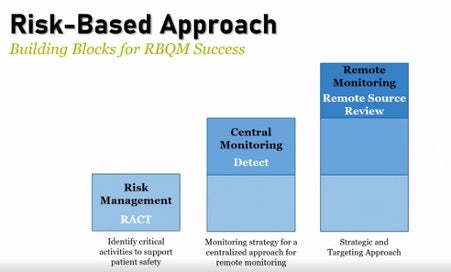
[원격 모니터링 최적화를 위한 위해성 기반 접근방식(Risk Based Approach)과 중앙통계분석(Detect)]
한편 유럽의약품청(EMA)는 효과적인 원격 소스 데이터 검토(rSDV)을 위해 3가지 조건을 제시하고 있습니다.
1.익명화 된 사본 (pseudonymized copies)
2.의무 기록에 대한 직접적인 접근 (direct access)
3.비디오 리뷰 (video review)
이 중 가장 일반적으로 활용될 수 있는 방법은 ‘익명화 된 사본’을 통한 rSDV로, 원격 모니터링은 개인신원확인정보(PII)와 의료정보(PHI)를 안전하게 관리하고 관련 규제 사항을 준수하는 플랫폼을 통해서만 원활하게 진행될 수 있습니다.
이에 메디데이터는 미국 FDA의 전자 기록 및 서명에 관한 규정, 21 CFR Part 11을 준수하고 업로드 된 데이터를 비식별화하여 개인정보 유출에 대한 위험을 사전에 방지하는 클라우드 기반 플랫폼, 리모트 소스 리뷰[FH1] (Remote Source Review, 이하 RSR)를 통해 CRA들이 의무기록을 원격으로 확인할 수 있는 방법을 구현하고 있습니다.
메디데이터 RSR 워크플로우 및 특장점
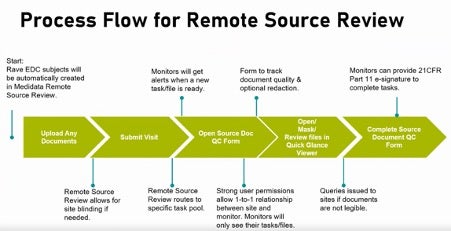
[임상 데이터의 확보부터 소스 데이터의 확인과 검토를 아우르는 메디데이터 RSR의 워크플로우]
메디데이터 RSR은 전세계 19,000여개의 기관 및 800여개 연구에 도입된 메디데이터의 의료영상 관리 솔루션, ‘레이브 이미징 (Rave Imaging)’ 시스템을 기반으로 구축되었으며, 아래와 같이 데이터의 수집부터 기입된 정보의 정확성 여부와 품질을 체크하는 모니터링의 전 과정을 가속화하는 다양한 장점을 갖추고 있습니다:
1. 간소화 (Simplification): RSR은 의료 정보 표준 규격 다이콤(DICOM) 등 데이터의 형식과 관계없이 모든 종류의 데이터를 지원하며, 클라우드를 기반으로 운영되기 때문에 용량 걱정으로부터 자유롭습니다. 또한 메디데이터의 전자자료수집 플랫폼, 레이브 EDC (Rave EDC)’와 연동되어 RSR에서 별도의 입력 작업 없이 데이터를 플랫폼에 생성합니다. 레이브 EDC를 사용하지 않을 경우에도 RSR 단독으로 사용 가능하며 안전한 브라우저 기반 접근을 통해 언제 어디서나 데이터를 입력할 수 있는 접근성이 특징입니다.
2. 통제성 (Control): 플랫폼의 데이터 편집 기능을 통해 임상시험 대상자의 민감한 정보를 보호할 수 있으며, 기관마다 특정 CRA에게 접근 권한을 부여할 수 있어 보안이 강화됩니다. 아울러, 의뢰사가 사전에 구축된 워크플로우에 따라 모니터링 과정이 체계적으로 운영됩니다.
3. 가시성 (Oversight & Visibility): 근거 문서는 업로드 즉시 확인이 가능하며, 알림과 함께 CRA에게 전달됩니다. 이와 더불어 RSR은 전체 진행 상황을 한 눈에 알아볼 수 있는 현황 리포트를 제공하여 모니터링 과정을 가속화합니다.
원격 모니터링과 관련된 각국의 가이드라인을 준수하여 즉시 진행중인 임상에 접목시킬 수 있도록 메디데이터 RSR의 워크플로우는 2주 안에 구현 가능하며, 모니터링 담당자를 추가하는 등 의뢰사의 요구사항에 따라 유연하게 구성할 수 있습니다. 또한 중앙집중식 통계 분석을 통해 데이터 품질을 보장하는 메디데이터 디텍트 (CSA Critical & Detect)와 연계 시 보다 통합적인 원격 모니터링 전략을 구축하여 리스크를 줄이고 임상시험을 가속화할 수 있습니다. 이와 같은 모든 장점을 통해 RSR은 현장 방문을 위해 소요되는 시간과 비용을 대폭 절감하며 원격 모니터링의 가능성을 실현하고 있습니다.
[메디데이터 RSR의 사용 화면 및 특장점]
