[NEXT Seoul 2023] 우리나라 분산형 임상시험 패러다임 : 단순한 비대면을 넘어 – 서울대학교병원
![[NEXT Seoul 2023] 우리나라 분산형 임상시험 패러다임 : 단순한 비대면을 넘어 – 서울대학교병원](https://www.medidata.com/wp-content/uploads/2023/08/SNU1-1024x683-816x0-c-top.webp)
* 해당 블로그 포스트는 NEXT Seoul 2023의 세션을 발췌하여 재구성한 내용입니다
유경상, 교수, 임상약리학과, 서울대학교병원
코로나19 팬데믹 이전까지 국내에서는 디지털 임상시험, 비대면 임상시험, 분산형 임상시험, 가상 임상시험, 원격 임상시험, 환자 중심 임상시험 등 다양한 용어를 혼용하여 사용해 왔습니다. 아울러 가상 임상시험은 임상시험 수행에서 ‘가상’ 절차를, 디지털 임상시험은 ‘디지털’ 절차를, 원격 임상시험은 ‘원격’ 절차를, 환자 중심 임상시험에서는 ‘환자 중심’을 강조하는 의미로 사용하고 있습니다. 하지만 현재는 이들 용어 DCT(Decentralized Clinical Trial)로 표준화되는 경향입니다.
DCT의 정확한 개념
FDA 가이던스에서는 임상시험 관련 활동의 ‘일부’ 또는 ‘전부’가 전통적인 임상시험 실시기관 ‘이외’에서 일어나는 것을 DCT로 정의합니다. 모든 절차를 꼭 원격으로 할 필요는 없다는 것입니다. DCT의 다양한 요소 중 하나 이상을 활용하면 DCT라고 할 수 있습니다. 또한, 임상시험 실시기관 외에서 수행되는 것으로 정의하는 만큼 반드시 ‘디지털’, ‘비대면’, ‘원격’이 수행되어야 한다는 의미는 아닙니다. 결론적으로 DCT는 항상 디지털이나 원격은 아니지만 적어도 일부 요소가 그러하다는 것이며, 전체적으로 환자가 좀더 편하게 임상시험을 할 수 있도록 하는 것입니다.
DCT 정의를 명확히 해야 하는 데는 그만한 이유가 있습니다. ▶첫째, 임상시험에 관계되는 각 주체들이 각기 다른 생각으로 용어를 사용하고 있고, 한 전문가 집단 내에서도 조금씩 다르게 이야기하기 때문입니다. ▶둘째, 국내에서는 DCT를 원격의료(telemedicine)와 연관 짓는 경우가 많습니다. 원격의료는 진료 측면을 다루는 것으로, 훨씬 광범위합니다. 이는 DCT의 핵심 요소 기술일 수는 있지만 필수 요소 기술은 아닙니다. ▶셋째, 임상시험과 의료에 대한 구분입니다. 임상시험 절차와 환자에 대한 구체적 의료 행위를 구분해서 생각해야 합니다. 그러나 국내의 많은 DCT 논의에서는 이 개념이 혼용되고 있습니다.
해외 DCT 가이던스에서 주목할 점
최근 유럽 EMA(2022.12), 미국 FDA (2023.05), 대만 TFDA (2023.06)는 DCT 가이던스를 속속 발간했습니다. ICH E6(R3) Annex 2에서도 DCT에 대해 명시적으로 언급할 예정입니다.
EMA에서는 ACT EU(Accelerating Clinical Trials in the EU)의 Priority action 8의 ‘Methodology guidances’ 중 하나로 DCT에 대한 규제를 마련하고 있습니다. EU 소속 국가가 많고 다양하기 때문에 개별 국가에서 먼저 가이던스를 발표하고, 이를 포괄하는 규정을 EMA 차원에서 만들고 있습니다. FDA는 2022년 말, FDORA(Food and Drug Omnibus Reform Act) 법 제정을 통해 FDA 규제 권한과 의무를 강화했으며, 2023년 말까지 DCT 가이던스를 마무리할 것을 법으로 명시했습니다.
이들 DCT 가이던스에서 주목할 것이 몇 가지 있습니다.
▶첫째, DCT는 모든 절차를 분산형으로 진행하는 것을 의미하지는 않습니다. FDA에서는 Fully DCT와 Hybrid DCT를 구별하여 서술하고 있습니다. 연구에 따라, 그리고 같은 연구라도 국가 및 실시기관 상황에 따라 다르게 진행될 수 있습니다. 예를 들어, 리스크가 높은 임상시험은 여전히 전통적인 요소들이 많이 사용될 수밖에 없습니다. 그렇지만 디지털치료제(DTx)는 Fully DCT로 하기에 적합한 특성을 많이 갖고 있습니다.
▶둘째, DCT 요소 도입이 임상시험 자료에 주는 영향을 평가해야 합니다. FDA에서는 DCT에서 얻어진 자료의 가변성(Variability)과 정확성(Precision)을 강조합니다. EMA도 DCT 자료가 가지는 한계를 평가하도록 권고하고 있습니다. 특히 시판을 위한 허가용 임상에서 DCT 요소의 영향 평가가 중요합니다.
▶셋째, 각 주체의 역할과 책임을 명확히 해야 합니다. DCT에서는 보다 다양한 관계자가 임상시험에 참여하게 됩니다. 따라서 각 규제기관에서는 이에 대한 구체적인 역할과 책임을 공통으로 강조하고 있습니다.
DCT 수행 사례에 기반한 고려사항
. 전자동의에 대한 이해도
서울대학교병원에서는 블록체인 기반의 전자동의 플랫폼(METORY)을 개발 및 이를 활용하여 임상시험을 진행했습니다. 해당 연구에서는 모든 절차를 전자동의로 진행했습니다. 하이 리스크 의약품이 아닌 가상 의약품으로 시험을 진행했기 때문에 완전 원격 수행이 가능했습니다. 다만 첫 동의는 대면 동의, 이후 동의는 원격으로 진행했습니다. 대상자는 매일 1회씩 체온을 측정해야 했고, 일부러 중간에 절차를 바꿔 오전에 측정하던 체온을 오후에 측정하게 했습니다.

그 결과, 비대면으로 설명하고 동의를 받았을 때 이해도가 기대했던 것만큼 높지는 않은 것으로 나타났습니다. 50% 정도가 제대로 이행하지 않았던 것입니다. 따라서 전자동의를 받는 과정에서 대상자의 이해도를 높이는 방안이 강구되어야 할 것입니다. 멀티미디어 요소 도입 등이 도움을 줄 수 있습니다. 다만, 요소 도입 자체보다는 디지털 지원을 보다 강화하고 행동 변화 관리를 고려해야 합니다.
. 디지털 기술을 통한 검증
서울대학교병원에서는 웨어러블 디바이스를 활용해 임상시험을 진행했습니다. 순응도 평가를 위해 한 그룹은 앱에서 자가 투약 기록을 입력하게 했고, 또 한 그룹은 스마트워치를 이용해 투약 동작을 인식하여 카메라로 촬영하고 동작 분석을 통해 약 섭취를 확인했습니다.
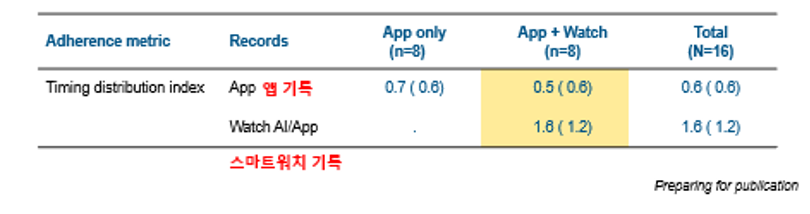
이를 비교한 결과, 앱에 직접 입력한 자발 기록과 스마트워치 기록에 큰 차이가 있었습니다. 이는 대상자들이 약을 정확한 지침에 따라 복용하지 않고 있음을 시사합니다. 따라서 디지털 기술에 대한 검증과 함께, 사람의 행동이 어떻게 바뀌는지, 행동심리학 요소가 결합되어야 이상적인 환자 중심의 임상시험을 할 수 있을 것입니다.
선제적 규제 마련을 위한 각국의 노력
각국의 규제기관에서는 공공-민간 파트너십을 통해 선제적으로 규제를 마련하며 복잡한 임상시험 환경을 헤쳐 나가고 있습니다. 미국 FDA와 듀크대학교는 2007년 CTTI(Clinical Trials Transformation Initiative)를 설립하여 80개사가 함께 DCT 등 새로운 임상시험 주제들에 대한 권고안 및 도구를 개발하고 있습니다.
EU에서는 2022년, EC-HMA-EMA의 협의체로 ACT EU(Accelerating Clinical Trials in the EU)를 설립하고, 10개의 Priority action을 설정하여 규제를 개선하고 있습니다. DCT는 8번에 해당합니다.
한편 우리나라에서는 식약처와 서울대학교가 2022년, 다주체 규제협의체로 ARICTT(Advanced Regulatory Innovation for Clinical Trials Transformation)를 설립하고 새로운 임상시험 환경에 선제적으로 대응하기 위해 노력하고 있습니다.
Contact Us
![[NEXT Seoul 2023] 우리나라 분산형 임상시험 패러다임 : 단순한 비대면을 넘어 – 서울대학교병원](https://www.medidata.com/wp-content/uploads/2023/11/hero1-scaled-2880x1200-c-top-2880x1516-c-top-1440x568-c-top.webp)