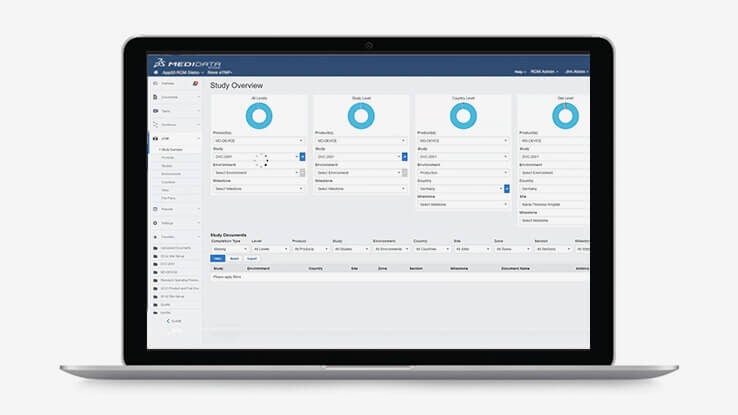
Medidata eTMF
TMF작업, 보관, 관리에 최적화
Medidata eTMF는 TMF 콘텐츠의 원활한 관리를 통해 시험에 맞춰 동시에 작성될 수 있도록 지원하는 뛰어난 보안을 자랑하는 글로벌 협업 플랫폼입니다.
Medidata eTMF는 다른 애플리케이션에서 생성 및 업데이트된 콘텐츠를 자동으로 입력함으로써 콘텐츠 생성 및 관리를 간소화합니다. 결과적으로 파일링 관련 수동 작업이 감소되며 단일 데이터 소스(Single Source of Truth)를 지원해 시험팀에게는 문서 생성 시간 및 시험기관 파일과 TMF 간 데이터 조정 시간 단축과 같은 상당한 효율성을 제공합니다. Medidata eTMF는 또한 최소한의 IT 관여로 간단히 배포할 수 있어 실행 일정은 8주면 충분합니다.
제품 강점
임상시험 수행 간소화
Medidata Platform와의 호환을 바탕으로 콘텐츠가 Rave EDC 및 Medidata CTMS로부터 자동으로 입력되어 TMF를 항상 완벽하게 유지할 수 있습니다. 그 결과 임상 시험 진행 상황에 대한 완벽한 파악을 지원하고, 실태조사 준비 상태를 보장하며, 시간과 리소스를 확보해 사용자가 가장 중요한 작업에 집중할 수 있도록 돕는 통합 솔루션이 탄생했습니다.
빠르고 정확하게 임상연구 진행
Medidata eTMF의 계획 및 구현은 검증된 Agile 방법론을 사용합니다. 일반적으로 Medidata eTMF 구성에서 Go-Live까지 8주면 가능합니다.
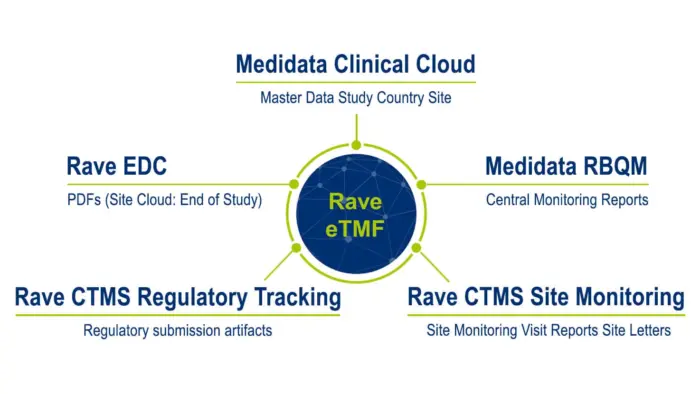
TMF 관리 간소화
Medidata eTMF는 임상시험 전체 주기에서 콘텐츠와 데이터를 통합해 임상 문서 제출 프로세스를 간소화합니다. Medidata Platform의 일부인 Medidata eTMF는 플랫폼 내 다른 애플리케이션의 콘텐츠와 데이터를 즉시 자동 입력할 수 있어 TMF는 항상 완성된 상태를 유지할 수 있습니다. 또한 새로운 임상시험 계획을 단 몇 분 내로 생성하고 파일 계획을 커스텀할 수 있습니다.
실시간 협업 강화
시험기관, 의뢰자, CRO 모두 직관적인 단일 애플리케이션에서 전체 TMF 주기에 대해 생성, 저장, 보기, 편집, 공동 작업을 할 수 있습니다.

주요 기능

종합적 검색
Rave eTMF의 고급 검색 알고리즘은 콘텐츠, 이름 및 메타데이터에 기반하여 TMF artifact 검색을 단순하고 정확하게 합니다. 자동 명명과 메타데이터를 이용하여 규제 및 비규제 콘텐츠를 모두 쉽게 검색하고 관리할 수 있는 표준화된 콘텐츠의 단일 플랫폼을 제공합니다.

TMF Reference Model
Rave eTMF는 DIA(Drug Information Association)의 TMF reference model에 대한 완벽한 지원을 제공하며, 즉시 사용 가능한 DIA 파일 계획 구성을 포함합니다.
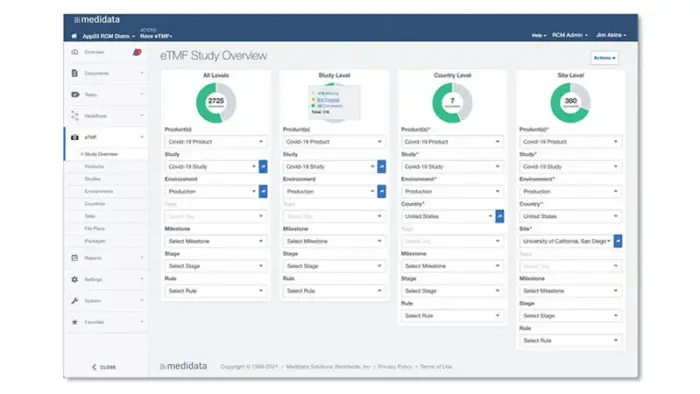
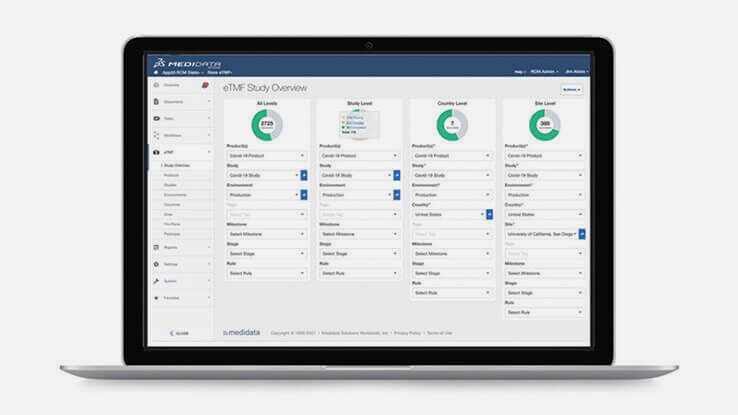
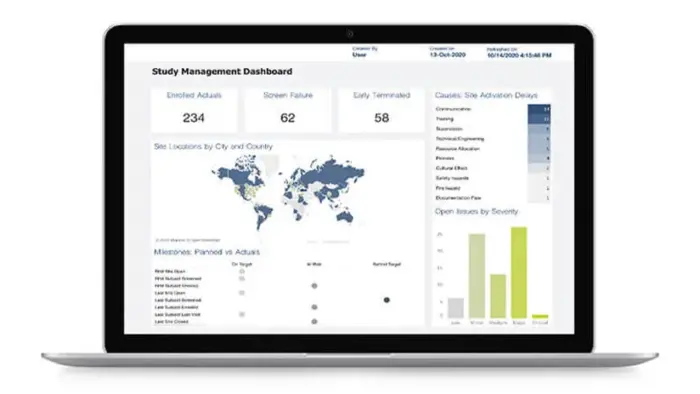
대시보드 및 리포팅
Rave eTMF는 포괄적인 대시보드 및 리포팅을 통해 제공되는 문서에 대한 실시간 감독 및 액세스를 바탕으로 사용자가 실태조사 준비 상태를 지속적으로 유지할 수 있도록 지원합니다.
관련 제품
Rave CTMS
Medidata CTMS (Clinical Trial Management System)는 지능형 자동화 및 워크플로 관리를 통해 시험, 국가 및 시험기관 감독 속도 및 효율성을 개선하며 EDC와 실시간 연동을 통해 임상시험 운영을 최적화 해주는 통합 CTMS 플랫폼입니다.

Rave TSDV
Rave EDC와 호환되는 Rave TSDV (Targeted SDV)는 CRA가 위해성 관리 활동을 통해 확인된 품질결정(CtQ) 요소에 집중할 수 있도록 지원합니다. 또한 선택적 SDV 표적화를 진행할 Rave EDC 폴더, 양식 및 데이터 필드를 확인합니다.
추가 정보
통합 문서 관리를 통한 임상시험 감독 간소화
TMF의 복잡성 증가로 인해 하루에 수천 개에 달하는 문서에 대한 관리 및 엄격한 규제 제출 요건이 요구되고 있습니다. Medidata eTMF는 협업 강화, 실시간 감독 및 자동화 문서 워크플로우를 통해 운영 효율성을 높입니다.

임상시험 모니터링 워크플로우 자동화를 통한 효율성 극대화
Enterin은 확인서 및 리포트 생성을 자동화하고 해당 데이터를 고위 경영진 및 시험기관 관리자와 보다 쉽게 공유하는 기능을 갖춘 솔루션을 위해 메디데이터의 도움을 구했습니다. Enterin은 Medidata eTMF를 채택함으로써 매주 5~6시간을 절약하고 시험기관의 부담을 줄일 수 있었습니다.

Rave eTMF + Rave CTMS 제품 비디오
메디데이터 플랫폼에 통합된 Medidata eTMF는 TMF 및 주요 artifact를 Medidata CTMS에 자동으로 입력해 결과를 최적화하고 데이터 품질을 개선합니다. 또한 임상시험 일정을 가속화하고 위험을 줄임으로써 팀이 가치가 높은 활동에 집중할 수 있도록 합니다.