Uncategorized @jp
【イベントレポート】CRCあり方会に出展、DCT利用状況に関する調査を実施
Reading Time: 2 minutes毎年恒例となった CRCと臨床試験のあり方を考える会議への出展ですが、今年はイーピーエス株式会社、… Read More

臨床試験実施施設におけるAIの利点
Reading Time: < 1 minutes臨床試験において、施設は常に中心的な存在です。しかし現在の限られたリソースとますます複雑化するプロトコルのもとでは、より強固なパートナーシップと十分なサポートが求められています。とはいえ、それは施設スタッフに可能な限り多くのテクノロジーやツールを押し付けることを意味するわけではありません。むしろ重要なのは、患者とのコミュニケーションなど本当に重要な業務により多くの時間を割き、データ入力のような繰り返し可能かつ自動化できる業務に費やす時間を減らせるよう、戦略的に力を与えることです。 人工知能(AI)は、この状況を大きく変えつつあります。資金や人員の不足が常態化している制約の多い環境において、サイトが成功するために必要なものをすべて備えることは、かつてないほど重要になっています。貴重な時間を解放し、効率・品質・スピードを大幅に向上させることで、そのメリットは明確であり、今後も機能の進化とともにさらに拡大していくことが期待されます。 ワークフロー開発の合理化 AIはすでに、事務的な負担を軽減し、より高い運用の柔軟性を実現する役割を果たし始めています。スケジュール調整、カレンダー管理、データ入力など時間を要する作業はAIツールに任せることで、医療従事者は研究の中でもより重要で付加価値の高い業務に集中できるようになります。… Read More

eTMF入門:臨床試験文書管理の進化
Reading Time: < 1 minutes急速に進化する臨床研究の世界において、試験に不可欠な文書を効率的かつ適切に管理することは極めて重要です。電子トライアルマスターファイル(eTMF)は、その管理方法に革新をもたらすソリューションとして登場し、臨床試験に関する記録の保存、管理、アクセス方法を大きく変えつつあります。従来の紙ベースのTMFでは、多大な手作業と物理的な保管スペースが必要でしたが、eTMFはそのプロセス全体をデジタル化することで、文書管理の効率化、コンプライアンスの確保、監査対応の迅速化を実現しています。 なぜeTMFが重要なのか FDA(米国食品医薬品局)、EMA(欧州医薬品庁)、MHRA(英国医薬品・医療製品規制庁)などの規制当局は、臨床試験における厳格な文書管理基準を義務付けています。eTMF(電子トライアルマスターファイル)は、こうした基準を満たすと同時に、業務効率を向上させるために設計されたソリューションです。紙ベースのファイルから電子システムへ移行することで、臨床試験チームはコンプライアンスの強化、手作業によるミスの削減、そして常に監査対応可能な文書状態の維持が可能になります。 かつては、臨床試験の文書は物理的なTMFで管理されており、かさばるうえに紛失のリスクも高いものでした。eTMFへの移行は、デジタル技術の進歩、規制要件の複雑化、そしてグローバルチーム間でのコラボレーションの必要性によって推進されてきました。これまでに、21 CFR Part 11(電子記録・電子署名の要件)への準拠、クラウドベースの保存ソリューション、および他の臨床試験システムとのスムーズな連携といった重要なマイルストーンを経て、eTMFは業界全体で広く導入されるに至っています。 eTMFテクノロジーの今後の展望… Read More

紙からデジタル、そしてバーチャルへ:臨床研究の過去・現在・未来
Reading Time: < 1 minutesエフェソスのヘラクレイトス(紀元前500年頃)は、「人生において唯一不変なものは変化である」と述べました。しかし、歴史を通じて、その変化が劇的に進む時期がありました。この30年間だけを見ても、私たちはかつてない技術的、社会的、ビジネス上の変革を経験してきました。そして今、私たちは再び大きな飛躍を遂げようとしています。 変革の一例として、コミュニケーション手段と技術の進化が挙げられます。楔形文字を刻んだ粘土板やパピルスの巻物から始まり、ポニー・エクスプレスによる郵便、電報、電話、テレックス、ファクス、そしてスマートフォンへと進化してきました。1990年代以降、インターネットの登場によって、電子メール、ソーシャルメディア、メッセージングアプリ、ビデオ会議などが普及し、私たちの生活や仕事のあり方は一変しました。未来に目を向けると、3Dホログラフィック通信や医療画像技術はすでに開発されており、技術基盤のさらなる進化によって一般的に採用される日が近づいています。 過去からの学び ジェームズ・リンドは「臨床試験の父」として知られる英国海軍の外科医であり、1747年に壊血病に関する最初の対照臨床試験の一つを実施しました。彼の研究は成功し、その結果を1753年に『壊血病論(Treatise of the Scurvy)』として発表しました。1… Read More

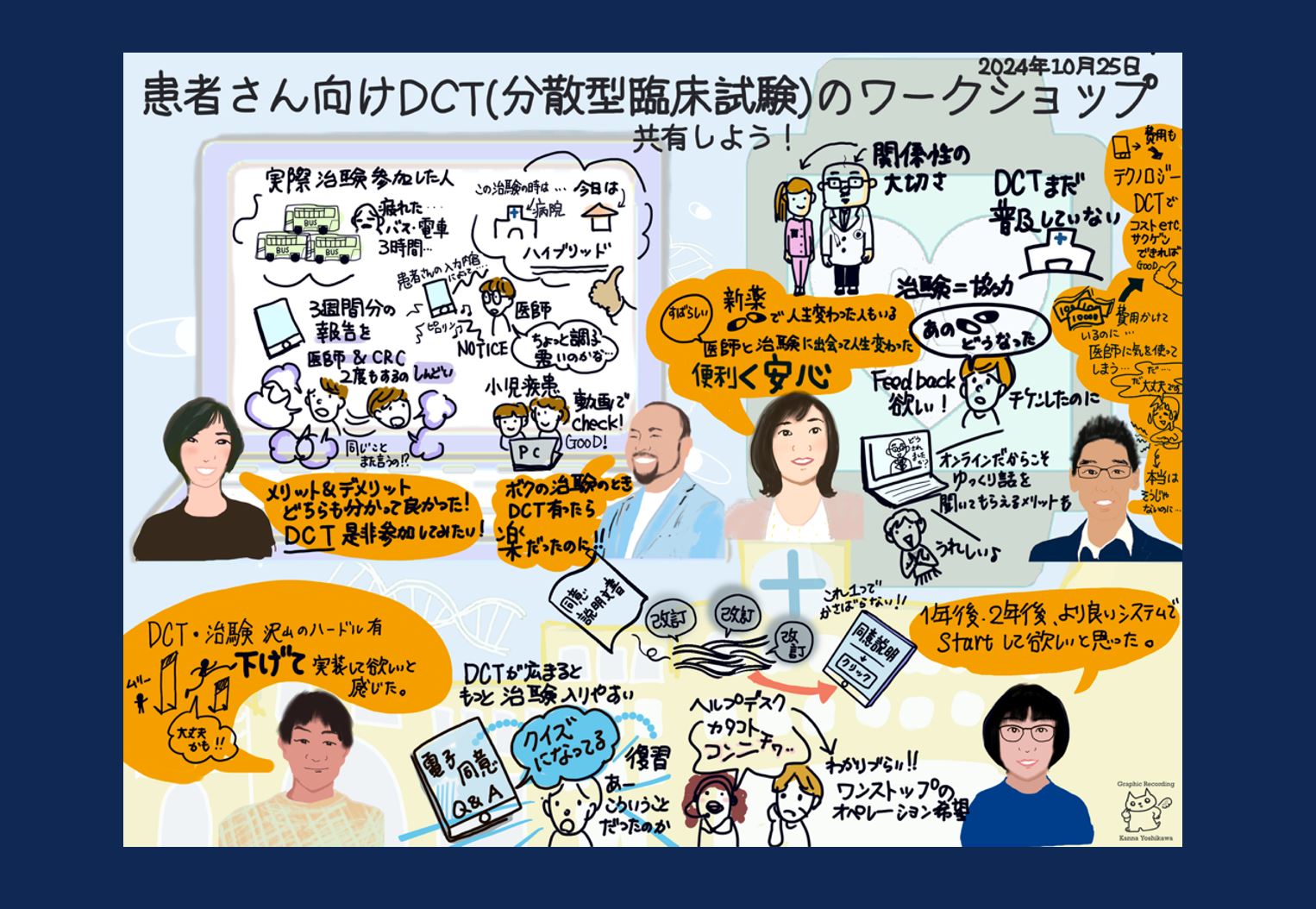
【イベントレポート】分散型臨床試験(DCT)ワークショップの開催報告
Reading Time: < 1 minutes2024年10月25日、東京都内において一般社団法人ピーペック協力のもと、イーピーエス株式会社とともに、「患者さんと一緒に考えるこれからの治験〜分散型臨床試験で変わる治験参加体験〜」をテーマとした分散型臨床試験(DCT)ワークショップを開催しました。本ワークショップは、DCTへの患者さんの想いや考えを理解しDCTが患者さんの治験体験に与える影響を理解し、より参加しやすい治験の実現につなげていくことを目的としています。6名の患者さん(うち4名が治験参加経験者)をお招きし、DCTに関する貴重な意見を伺いました。 本イベントは、「聞いてみよう!」「触れてみよう!」「話してみよう!」「共有しよう!」の4つのセッションで構成されました。それぞれのセッションで、DCTの概要を理解し、実際にDCTツールを体験し、患者さんの声を深掘りしました。… Read More
【イベントレポート】CRCあり方会に出展、DCT利用状況に関する調査を実施
Reading Time: 2 minutes2024年9月15日・16日に札幌で開催された「CRCと臨床試験のあり方を考える会議」(以下「あり方会」)に出展いたしましたので、その報告をさせていただきます。 メディデータは、「あり方会」を通じて、医療機関で働くCRCの皆様に対し、臨床開発のデジタル化の現状や今後の変化について情報を提供し、臨床開発業務のデジタル化への理解を深めていただくことを目的とし毎年出展をしています。また、臨床開発ソリューションを提供する企業として、皆様からのフィードバックは、医療現場の現状を理解する貴重な機会であると考えています。 2024年は、eConsentを始めとするDCT関連のソリューションの紹介に加えて、昨年に引き続きEHRデータをEDCに取り込むRave EDCの一部機能であるRave Companionのご紹介、そして機能を実際に体感してもらうCompanion Challengeを実施し、CRCさんに入力スピードを競っていただきました。日々のEDCへのデータ入力はCRCにとって大きな負担になっている中で、Rave Companionの機能により93%(n=61)の方がEDCへのデータ入力の負担が減るとの回答がありました。 参考:過去の出展について ・2022年:… Read More

エンドポイント審査プロセスを最適化する:今日と未来に向けて
Reading Time: 2 minutesMedidataは、第3回年次Optimizing Your Endpoint Adjudication Process Today and Beyond(エンドポイント審査プロセスの最適化:今日と未来に向けて)オンラインイベントにご参加いただいた皆様に感謝申し上げます。このイベントでは、業界のリーダーや同僚が集まり、臨床試験におけるエンドポイント審査の重要な側面について議論しました。 今年は、2つの専門家パネルが、エンドポイント審査における共通の課題とベストプラクティスに関する知見を共有するとともに、人工知能/機械学習(AI/ML)の統合に向けた将来のビジョンを示しました。 エンドポイント審査プロセスを向上させるための洞察をご覧ください。 パネル1: 難しい審査試験から得た教訓 スピーカー:… Read More
