
現在、臨床試験業界はいくつもの課題に直面しています。プロトコルの複雑化により、患者を確保し高品質なデータを提供できる医療機関を確保することが難しくなっています。遠隔や分散型でのデータ収集によって柔軟性は高まったものの、依然として患者の継続参加は大きな課題です。さらに、データソースの多様化や関係者数の増加が、運営面で大きな負担となっています。そして、明確な指針がないまま、変化し続ける国際規制の状況に対応することも難しさを増しています。
では、これらの課題にどう対処すべきでしょうか。
その答えの一つが、リスクベース品質マネジメント(RBQM)の枠組みです。プロトコル作成から申請まで、一貫したリスクベースの品質管理・モニタリングを可能にするこの枠組みは、関係者とプロセスをつなぎ、協働、効率的な業務、高品質なデータ、そして患者安全の確保を実現します。ただし、テクノロジーを伴わない枠組みは、理論としては有用でも、実務への影響力は限定的です。
これらの課題に対応するためには、業界全体がリスクベースのアプローチと革新を取り入れ、すべてのデータへのリアルタイムアクセス、過去データからのインサイト活用、さらに自動化やAIを活用して包括的なデータモニタリングを実現する必要があります。
臨床試験エコシステムの課題
プロトコルと規制の複雑化の進行
臨床試験の設計や実施がますます複雑化する中で、そのパフォーマンスを最適化し、プロトコル遵守を維持することは一層困難になっています。さらに、急速に変化する国際的な規制ガイドラインへの対応は、より難しい課題です。規制当局はしばしば高レベルで抽象的な指針を示すにとどまり、解釈の余地が大きく、不確実性を生み出します。その結果、「安全策」として、より厳格で従来型の実施方法に戻ってしまう傾向が生じています。
施設選定、患者募集と維持
臨床研究エコシステムの複雑化に伴い、研究に参加したり患者を登録したりできる経験豊富な治験責任医師の数は減少しています。さらに、施設選定はこれまで、施設の実績、患者集団、医師の経験に関する十分に信頼できるデータに基づいて行われてこなかった経緯があります。そのため、十分な患者を登録し、高品質なデータを提供できる最適な施設を選定することが難しくなっています。
患者募集は、競争環境の激化、認知度不足、物流面での障壁などにより、依然として大きな課題です。特に多様な背景を持つ患者の登録を妨げる要因となっています。また、患者の全体的な負担感、関心の低下、そして十分なメリットが得られないという認識が、患者の継続参加をさらに難しくしています。
膨大なデータ量
データ量とその生成スピードは増加の一途をたどっており、特に電子カルテ(EHR)や診療記録(EMR)、センサーからの継続的なデータ、画像のような非構造化データが加わることで、すべてを一元的に処理・統合・分析することは困難になっています。さらに、さまざまなシステムやソースから得られるメタデータがデータエコシステムにおける重要要素となり、データクレンジングの手法を一層複雑にしています。
分断されたエコシステム
製薬スポンサー、CRO、医療機関は、多くの場合、相互に連携しない専門特化型のスタンドアロン技術を寄せ集めて運用しています。その結果、業務の重複、遅延、複数システムに分散した断片的なデータが生じ、管理が困難になります。従来の縦割り型プロセスでは、今日の複雑でデータ量の多い試験に対応しきれず、洞察の遅延、スケジュールの延長、コスト増につながります。統合システムがなければ、試験全体の監督やプロトコル遵守の一貫性を確保することも難しくなります。
関係者の多様化
これまで患者は主に「研究対象」として見られてきましたが、現在では患者が重要なパートナーであるという認識が高まっています。患者の実体験や嗜好、フィードバックは、試験デザイン、プロトコル作成、リクルート戦略、さらには結果の公表においても重視されるようになっています。この変化により、患者支援団体、個々の患者アドボケイト/アドバイザー、介護者や家族といった新たなステークホルダーが登場しました。
また、従来のCROなどのサービス提供者に加え、あらゆる計画や協働の段階に関与すべき専門性の高いニッチベンダーも台頭しています。さらに、リアルワールドエビデンスの活用が進む中で、日常診療に携わる医師や医療機関が、匿名化された患者データを研究に提供する役割が重要になり、治験責任医師以外の医療提供者も欠かせないステークホルダーとなっています。
RBQM導入状況
RBQMの有効性は広く認識されているにもかかわらず、その導入率は期待ほど高くありません。ただし、初期リスク評価や一部の中央化モニタリングを中心に、導入は徐々に進んでいます。ある業界調査によれば、2023年には臨床試験の88%が少なくとも1つのRBMまたはRBQM要素を採用しており、これは2019年の53%から大きく増加しています。それでもなお、認知不足、知識・スキルの欠如、そして技術面の課題が導入の妨げとなっています。
360°モニタリング・フレームワーク
IMAGINEは、利用可能なすべてのデータを活用し、試験デザインの立案、重要事項の評価、関係者間のワークフローやコラボレーションの促進、より効果的な計画策定、そして適応型リスクモニタリングを可能にする、統合かつ自動化されたアプローチを提供することで、こうした課題の多くに対応する360°モニタリング・フレームワークです(図1)。
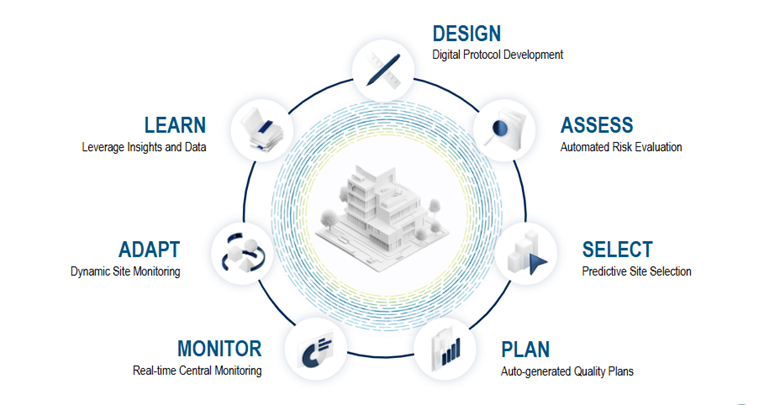
臨床試験の変革:デジタル化されたプロトコルがもたらす効率性と正確性
過去のデータやインサイトを組み込んだデジタル化されたプロトコルは、すべての関係者とシステムにとって一貫性があり正確な情報源として機能し、臨床試験の実施を最適化します。これにより、電子データ収集(EDC)、臨床試験管理システム(CTMS)、リスク評価プラットフォーム、統合品質マネジメント計画など、下流の各システムへの自動反映が可能になります。この「一度作成し、何度も活用する」手法により、試験準備段階での手動入力作業が大幅に削減され、膨大な工数を節約できます。また、人為的ミスの低減、プロトコル改訂の効率化、関係者間のコラボレーション強化にもつながります。
スマートなリスクマネジメント:クリティカルシンキングとデジタルツールの融合
テクノロジーの進化によってリスクマネジメントは変革を遂げていますが、実践的なリスク評価の基盤となるのは依然として人間の判断です。文脈を理解し、分析する力は代替できません。自動化やデータ活用は、このクリティカルシンキングを支援する強力なツールであり、置き換えるものではありません。
デジタル化されたプロトコルは、業務効率化の中核的役割を担います。品質に直結する重要因子(CTQ)の特定を自動で行い、さまざまなワークフローにデータをシームレスに反映します。これには、電子データ収集(EDC)の設計やデータ/モニタリング計画の作成から、リスクモニタリングツールの設定までが含まれます。
この統合により、即時的な効果が得られます。リアルタイム通知によって試験のリスクプロファイルの変化を即座に把握でき、チームは迅速かつ能動的にモニタリング戦略を調整できます。これらは、常に中央化モニタリングツールにログインし続ける必要なく実現でき、大幅な効率化につながります。
さらに、過去データは極めて有用です。過去のリスクや、特定の試験タイプや適応症における成功したリスク低減策を参照できる貴重な情報源となります。この知見を活用することで、チームは過去から学び、効果的な解決策を現在および将来の課題に適用できます。
施設選定の高度化:最適なパフォーマンスを実現するデータドリブンアプローチ
臨床試験で最適な施設選定を実現するには、より信頼性の高いデータドリブンなインサイトへの移行が不可欠です。そのためには、いくつかの重要なポイントを考慮する必要があります。
-
まず、過去の施設パフォーマンスデータを一元的に集約したリポジトリの構築が重要です。ここには、過去の登録率、データ品質指標、プロトコル逸脱の発生率、試験スケジュール、規制遵守履歴、治験責任医師の経験、施設スタッフの離職率といった主要な指標を含めます。この包括的な視点が、その施設の能力を把握する基盤となります。
-
この基盤の上で、将来の施設パフォーマンスを予測する高度なアルゴリズムの開発と適用が不可欠です。これらのアルゴリズムは過去データを活用し、施設の患者登録能力やデータ品質を予測します。治療領域、地理的条件、特定の患者層、治験責任医師の詳細なプロフィールなどの要因を組み込むことで、予測精度を大幅に高めることができます。
-
業界が歴史的に苦戦してきた領域のひとつは、真に包括的な施設・治験責任医師のパフォーマンススコアの作成です。従来は登録数に重点が置かれがちでしたが、私たちはよりバランスの取れた動的かつデータドリブンなスコアを提案します。これらのスコアは、患者登録の実績だけでなく、特定の治療領域や患者集団、試験フェーズにおいて、期限内に高品質なデータを継続的に提供してきた実績を反映すべきです。これにより、単なる経験の有無ではなく、量と質の両面で成果を出す能力を定量化できます。
-
さらに、患者集団のマッピングは不可欠です。匿名化かつ倫理的に取得された電子カルテ、保険請求データ、公衆衛生統計といったリアルワールドデータを統合することで、疾病の有病率や患者属性を地理的にきめ細かく把握することが可能になります。
統合品質・リスクマネジメント:臨床試験のデジタルコックピット
統合品質・リスクマネジメント計画(IQMP)は、臨床試験管理における重要な進化形です。これは単なる文書ではなく、デジタル化されたプロトコルと堅牢なリスク評価によって自動作成され、運用される動的なフレームワークです。
IQMPは、すべての関係者が統一された計画のもとで協働できる中央ハブとして機能し、縦割り型アプローチによる非効率を排除します。誰が何を担当しているのかを明確に可視化し、業務の重複をなくし、重要なギャップを解消することが可能になります。
すべての下流工程を統括するコックピットとして機能するデジタルIQMPは、試験運営を精密にコントロールします。これにより、データ・施設・リスクモニタリング用ツールのセットアップが容易になり、リアルタイムでのコンプライアンスチェックが可能となります。このインテリジェントなシステムは、過剰または不十分な注力が行われている領域や、データレビューや施設訪問頻度など、事前に定めた頻度や範囲が守られていない領域を自動的に特定し、可視化します。
リアルタイムリスク監視:AIによる中央化モニタリングの革新
自動化されたシグナル検出と分析により、データ品質、患者安全、施設パフォーマンスを包括的かつリアルタイムで監視できるシステムが実現します。これにより、中央モニターは、主要リスク指標(KRI)、品質許容限界(QTL)、統計的中央解析といった個別のシグナルや問題を特定するために、複数のツールを長時間かけて確認する必要がなくなります。
この中央化モニタリング環境はメタデータによってさらに強化され、その中で生成AIが重要な役割を果たします。生成AIは、監査データをリアルタイムに処理し、施設コンプライアンスのばらつきを特定し、適切なデータアクセスと監督を確保し、さらには不正や不適切な行為の兆候までも検出できます。
こうして中央モニタリングに基づくワークフローは、課題管理機能と連動しながらオンサイトモニタリング活動へシームレスに情報を提供し、真に統合された能動的なオーバーサイトを構築します。
動的モニタリング:中央集約型インテリジェンスによるオンサイト対応最適化
中央化モニタリングから得られるインサイトは、オンサイトモニタリングの在り方を大きく変革し、現場での長時間滞在の必要性を大幅に減らし、従来のソースデータ検証(SDV)の重要性を低下させています。電子カルテと電子データ収集システムを直接統合することで、転記作業が不要となり、転記ミスも発生しないため、SDVは事実上不要となります。その結果、重点はソースデータレビューや重要なプロセス改善の議論へと移ります。
オンサイトモニターが特定したリスクは、統合された課題管理を通じて自動的に中央モニタリングにフィードバックされます。これにより、全体的なリスクマネジメントプロセスと連動した継続的かつ効率的なフィードバックループが構築され、動的で適応的なモニタリング戦略が実現します。
データドリブンの卓越性:360°モニタリングの基盤
インサイトや過去データは、現在および将来の試験に活かすことができ、プロトコル設計、リスク評価、モニタリング戦略の立案を支援します。包括的なデータ収集により、必要に応じて柔軟に対応でき、将来のプロトコル最適化や、360°モニタリングプロセスへのフィードバックが可能になります。
360°モニタリングフレームワークを実現するには、統合型プラットフォームソリューションが重要です。これにより、分散したデータソースを一元管理し、オーバーサイトの強化とプロセスの効率化を実現します。これらのテクノロジーは、シームレスなデータ統合とコラボレーションを支え、リアルタイム分析や臨床試験ライフサイクル全体にわたる効果的なRBQMを可能にします。
まとめ
360°モニタリング・フレームワークは、人間のクリティカルシンキングと高度なデジタルツールを統合し、臨床試験のオーバーサイトを革新するアプローチです。その中心には正確かつ一元的な情報源としてのデジタル化されたプロトコルがあり、EDC設計からリスク評価までのワークフローを自動化し、手作業とヒューマンエラーを大幅に削減します。これにより、リアルタイムのインサイトを活用したスマートなリスクマネジメントが可能となり、過去データを用いた能動的な意思決定も支援します。
また、このフレームワークは包括的な施設パフォーマンス指標やリアルワールド患者集団マッピングを含むデータドリブンなインサイトにより、施設選定のプロセスも革新します。さらに、統合品質・リスクマネジメント計画(IQMP)を「デジタルコックピット」として提供し、関係者全員の協働を一元化します。加えて、AIによるリアルタイムリスク監視で継続的なモニタリングを実現し、動的モニタリングでは従来のSDVからデータレビューやプロセス改善へと重点をシフトさせ、試験ライフサイクル全体を通じた継続的なフィードバックループを確保します。
メディデータのソリューションについて詳しく知るには、Medidata CTMS および Medidata Clinical Data Studio のページをご覧ください。
Contact Us
