
在临床试验的应用中,AI工具要提供精准的分析洞察,历史临床试验数据有其独特适用性,尤其是在回答具有挑战性的临床开发问题上。这在Medidata与百时美施贵宝(BMS)的案例得到了充分诠释。在现有治疗方案有限且监管对替代终点数据质量及分析方法要求严格的情况下,Medidata依托自身海量、精准的患者级别的历史试验数据集及创新AI对比模型,为BMS提供了卓越的试验洞察,成功向监管机构证明了替代终点的有效性,切实做到了为试验提质增效。
AI井喷式发展,为药物研发赋能
随着人工智能(AI)的井喷式发展和加速迭代,其在临床试验中的应用也不断加深。通过外部数据分析提供精准的决策洞察,AI能够帮助临床试验提质增效。达索系统旗下品牌Medidata 为生命科学行业提供分析及AI解决方案,助力申办方解答所有临床试验的核心命题:患者为何选择使用他们的药物。比如,在癌症药物研发中,基于癌症治疗早期阶段的信号能够验证药物对患者的潜在疗效及持久、积极的临床获益。
2024年3月,美国食品和药品管理局(FDA)宣布加速批准BMS研发的首个用于治疗复发/难治性慢性淋巴细胞白血病(R/R CLL)或小淋巴细胞淋巴瘤(SLL)成人患者的CAR-T细胞疗法——Breyanzi(lisocabtagene maraleucel;liso-cel)。该突破性成果为接受过包括BTK抑制剂和BCL-2抑制剂两线治疗的患者开辟了新的治疗方案。1
接下来,我们将以和百时美施贵宝(BMS)在其CAR-T 细胞疗法 Breyanzi的应用案例重点介绍Medidata的AI解决方案如何帮助BMS优化试验方案,为其获批FDA加速批准提供了关键性证据,切实做到了加速从试验到上市的进程。
传统试验方案可行性低,试验难度加倍
CLL及SLL是成年人常见的白血病,通常表现为血液、骨骼或是淋巴结中的淋巴细胞异常。此类疾病进展缓慢,大多数患者需要长期应对但治疗困难2,3,试验若以传统指标为终点需要多年随访,耗时耗力;与此同时,患者亟需有效疗法,长期等待传统指标结果会进一步让更多患者延误治疗机会,也会造成试验招募难。综合评估后,BMS认为替代终点或可成为“破局”的关键——通过将患者治疗后一年内完全反应(CR)/部分完全反应(CRi)作为无进展生存期(PFS)的替代终点,期以获得FDA的上市加速批准。
然而,FDA虽然认可BMS的试验设计,但要求BMS必须提供强有力的临床验证和统计学证据。为符合FDA对替代终点严格的审核标准,BMS不仅需要证明CR/CRi与患者长期生存之间有明确关联,同时还需要证明其所使用的数据是有效的对比数据。
挖掘试验数据潜力,人工智能或成破局关键
通常,为证明某一替代终点是否适用于一款新型药物的某种作用机制,可以用历史数据来验证其短期治疗反应总体上与长期生存率相关,且适用于任何作用机制。
BMS需要可信的外部数据进行有效的临床对比验证,为其补全“统计学证据”。BMS将这项重要的任务交给了Medidata。
Medidata的数据积累汇集来自36000多项涵盖不同的疾病领域和作用机制的临床试验、超1100万名患者的历史试验,这使我们成为开展此类研究的最佳证据来源之一。从许多不同作用机制的历史数据中,我们看到短期治疗反应与长期生存率的关联性很强,所以我们有理由认为监管机构会同意将这种关联性沿用至新的作用机制。
立足BMS的目标,我们汇总了来自5项以上的历史临床试验数据集,包含1600多名先前接受过至少一种治疗方案(BTKi、BCL2i、PI3K或抗CD20单克隆抗体)的复发/难治性CLL/SLL患者数据。同时,为评估治疗后12个月达到并维持CR/Cri与患者长期生存之间的关系,也做了时间-事件分析。
基于以上历史数据集,Medidata在数周内为BMS搭建了对比模型,并将预后因素及治疗后反应的数据对比分析结果给到了BMS,以支持其临床试验和监管会议的时间安排。
所有患者中,CR/CRi的比例为15.08%。依据Landmark分析法控制时间偏倚,Medidata对比数据证明了治疗后12个月内实现并维持CR/CRi与长期生存结果改善显著相关,调整后风险比(HR)为0.62(95%置信区间:0.42–0.90,p值=0.01)。与此同时,与仅部分缓解(PR)或完全没有缓解(nPR)的患者相比,治疗后保持CR/CRi的复发或难治性CLL/SLL患者的生存优势更明显,且优于未达到任何缓解或换届后未能维持的患者(如下图)。
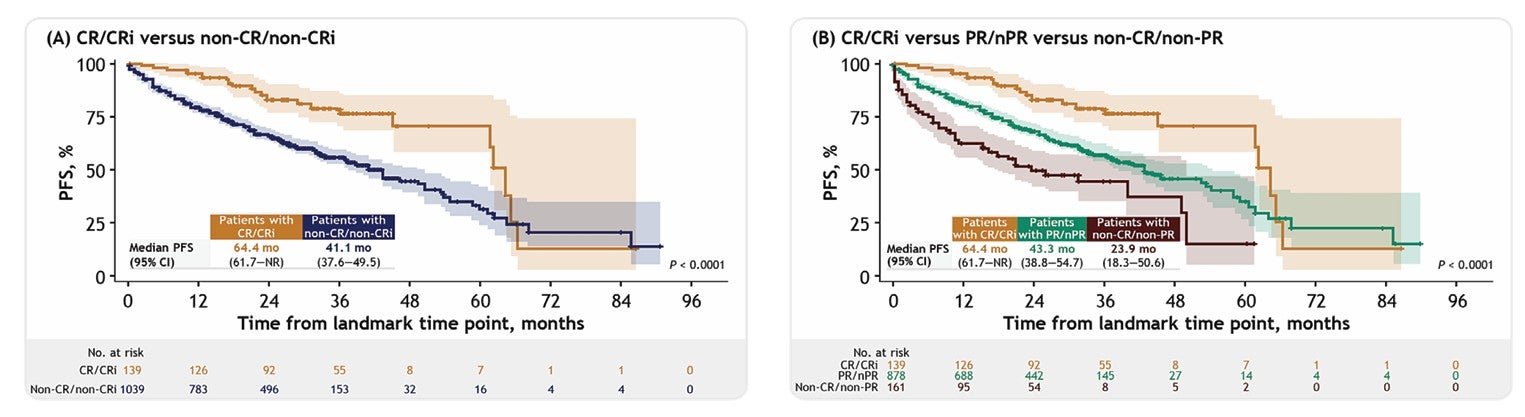
结果显示,治疗后12个月内的CR/Cri反应可以是评估患者人群无进展生存期的一个早期反应终点。这为BMS向FDA申请加速批准上市提供了基础证据,从而使其成为FDA对CLL/SLL患者CAR-T治疗的首个批准。
以上试验证据以及BMS所提供的其他证据使得该药物的上市时间提前数年。BMS这一成功案例将可能彻底改变肿瘤临床试验的设计,缩短试验时间,并节约开发成本,也进一步证明了强大稳健的AI工具在临床研发中的价值以及其在赋能创新药研的潜力。
2 American Cancer Society. Cancer Faots & Figures 2022.
3 Typical Treatment of Chronic Lymphooytic Leukemia. Accessed January 8, 2025. https://www.cancer.org/cancer/types/chronic-lymphocytic-leukemia/treating.html
Contact Us
